Стентирование коронарных артерий
Содержание:
- Обсуждение полученных результатов
- Какие осложнения бывают после установки стентов? Сепсис и другие
- Стентирование коронарных артерий
- Что такое «стентирование»?
- Результаты проведенных исследований
- Список литературы
- 6 Шунтирование сосудов сердца
- Возможные осложнения после процедуры
- Как выполняется стентирование в ЦЭЛТ?
- Область применения стентирования
- Какие есть способы введения стентов в организм? И в каких случаях какие делают?
- Дискуссия.
- Послеоперационный период и реабилитация
- Сравнение стентирования и шунтирования: их плюсы и минусы
Обсуждение полученных результатов
Идея временного устройства для устранения опасного осложнения баллонной ангиопластики – окклюзирующей диссекции интимы – не нова. Перфузионные баллоны появились на заре эндоваскулярной []. Они позволяли проводить длительную баллонную дилатацию как бы «приклеивая» отслоенный участок интимы, сохраняя при этом минимальный уровень кровотока дистальнее участка поражения. В ряде случаев, этот способ позволял устранить диссекцию []. С появлением стентов, проблема диссекции внутри артерии стала практически решаемой. Имплантация стента стала рутинной процедурой, потому как позволяет добиваться лучших непосредственных и отдаленных результатов по сравнению с баллонной ангиопластикой. В то же время рестеноз внутри стента вследствие гиперплазии интимы, как реакции на имплантант, отмечается в 15-50% случаев после эндопротезирования . Удаление стента спустя некоторое время после имплантации, теоретически может быть лишено этого недостатка. Технически этого можно выполнить различными путями. Есть экспериментальные исследования по использованию временных стентов из нитинола, обладающих эффектом «памяти» (). Быстрое согревание теплым физиологическим раствором позволяет «свернуть» стент до минимального диаметра и удалить через доставляющее устройство. Несовершенство конструкции подобных стентов и риск термической травмы не позволили внедрить эти разработки в клинику. Другой подход – использование стентов спиралевидной конструкции, которые скручиваясь уменьшаются в диаметре и могут быть удалены через катетер []. Как известно, стенты спиральной конструкции не обладают достаточной радиальной жесткостью и в связи с этим на сегодняшний день в клинической практике практически не используются.
Нам не известны работы, в которых использовался бы временный стент, основу которого составляет апробированный и внедренный в клиническую практику стент. Ряд положительных качеств ZA-стента, из которых следует отметить высокую радиальную жесткость, отсутствие укорочения и гибкость, позволяют использовать его самых различных клинических ситуациях. В нашей работе доказана принципиальная возможность безопасного удаления ранее установленного временного ZA-стента. Это технологическое достижение. Показано, что первичный эффект стентирования сохраняется и после удаления стента. Экспериментально установлено, что наиболее оптимальным сроком для удаления временного стента являются 7 сутки. Если дальнейшие клинические исследования подтвердят эффективность временных стентов, то в будущем возможно использование временных стентов как фармакологических матриц для прицельной доставки в эндотелий артерий субстанций, обладающих антипролиферативным, цитостатическим или противовоспалительным действием.
Какие осложнения бывают после установки стентов? Сепсис и другие
Стентирование сосудов сердца
– малоинвазивная операция, которая редко приводит к осложнениям, но исключать их развития все же не стоит. К возможным негативным последствиям вмешательства относят:
- вероятность повреждения сосудистой стенки в ходе вмешательства;
- развитие кровотечения в месте введения стента с проводником;
- развитие гематомы в месте введения;
- аллергические реакции на материал или покрытие стента;
- аллергические реакции на контрастирование, вводимое во время операции для контроля за ее ходом;
- образования тромбов в месте установки стента (для профилактики этого осложнения пациентам назначают препараты, уменьшающие свертываемость крови).
Редким, но опасным осложнением стентирования считается сепсис или, как его еще называют, . Развивается он в том случае, если в ходе операции врачами не соблюдались правила асептики и антисептики, использовался не одноразовый материал или плохо обработанные инструменты.
Стентирование коронарных артерий
Кровеносные сосуды, непосредственно питающие сердце, называются коронарными артериями.
Стент — это инородное тело, следовательно, он может вызывать нежелательную ответную реакцию организма у пациентов,
которым имплантированы обычные металлические стенты — повторное сужение сосуда (рестеноз).
Чтобы уменьшить возможность возникновения этой проблемы, разработаны стенты, покрытые полимером, выделяющим лекарственные вещества,
предназначенные для решения этой проблемы. Ими проводится стентирование сосудов сердца для повышения контроля над данным процессом.
В настоящее время коронарное стентирование, в зависимости от показаний, проводится стентами с лекарственным покрытием.
Подобные стенты стали новым словом в технологиях эндоваскулярных вмешательств и вывели это направление медицины на новый, более высокий уровень.
Ранняя диагностика и современные высокотехнологичные методы лечения сердечнососудистых заболеваний значительно улучшают отдаленные результаты.
Основные методы диагностики:
-
Электрокардиография (ЭКГ) — регистрация электрической активности сердца.
Показывает нарушения сердечных сокращений. ЭКГ проводится как в покое, так и во время нагрузки (нагрузочный тест — ходьба, бег, велосипед). -
Эхокардиография (ЭхоКГ) — исследование сердца с помощью ультразвука.
Дает более точную анатомическую и функциональную информацию. -
Внутрисосудистый ультразвук (ВСУЗ) — инвазивное исследование артерии с помощью катетера
с ультразвуковым датчиком, дает наиболее точную информацию о состоянии артерии «изнутри». -
Коронарная ангиография — исследование, выполняемое в ангиографической лаборатории.
Это рентгенологический метод, который дает возможность оценить тяжесть поражения артерий, местоположение критических стенозов, оценить риски и
определить тактику лечения.
Что такое «стентирование»?
В некоторых случаях после установки стента может развиться такая серьезная патология, как повторное сужение сосуда в том же месте, так называемый рестеноз.
Развивается рестеноз довольно редко, а причинами его формирования могут быть следующие:
- индивидуальная непредсказуемая реакция сосудистой стенки на присутствие инородного тела;
- изначально тяжелая патология сосудистой стенки, которая обычно сопровождает такое системное заболевание, как сахарный диабет, который в первую очередь пагубно действует на сосуды;
- неправильно выбранный вид стента.
Рестеноз, как осложнение стентирования, встречается в 4-30% случаев. Наличие сахарного диабета в анамнезе у пациента сильно повышает риск развития этой патологии.
Однако, в последние годы при стентировании используют стенты нового поколения, покрытые специальной оболочкой, пропитанной лекарственными веществами. Медикаменты, которые выделяются оболочкой стента, препятствуют повторному развитию стеноза.
Врач может заподозрить повторный стеноз в том случае, если пациент вновь обращается с жалобами на стенокардические боли, с момента первого вмешательства прошло менее полугода.
Если рестеноз в месте установки первого стента удается подтвердить при помощи методики коронарографии, то может быть два пути решения проблемы:
- ангиопластика;
- еще одна операция по установлению стента.
Старый стент при повторном вмешательстве не извлекают, вместо этого в сосуд вводится новый стент, который устанавливается внутри старого и снова расширяется.
Термином «стентирование» называется операция по установке стента внутри артерии, в результате которой проводится механическое расширение суженной части и восстановление нормального кровотока к органу.
Операция относится к эндоваскулярным (внутрисосудистым) хирургическим вмешательствам. Проводится в отделениях сосудистого профиля.
В хирургии налажены методики не только коронарного стентирования (сосудов сердца), но и установка стентов в сонной артерии для устранения признаков ишемии мозга, в бедренной — для лечения атеросклеротических изменений ног, в брюшной аорте и подвздошной — при наличии выраженных признаков атеросклеротического поражения.
Стент — это легкая сетчатая трубка, достаточно прочная, чтобы обеспечивать каркас артерии длительное время. Стенты изготавливаются из сплавов металла (чаще кобальта) в соответствии с высокими технологиями. Существует множество видов. Они отличаются по размерам, структуре сетки, характеру покрытия.
Можно выделить две группы стентов:
- без покрытия — используются при операциях на артериях среднего размера;
- покрытые специальной оболочкой из полимера, выделяющей в течение года лекарственное вещество, препятствующее повторному стенозу артерии. Стоимость таких стентов значительно дороже. Они рекомендованы для установки в коронарных сосудах, требуют постоянного приема лекарств, снижающих образование тромбов.
Результаты проведенных исследований
Имплантация 38 стентов прошла без осложнений. В двух случаях стенты раскрывались не полностью, что требовало баллонной дилатации внутри стента. В двух других случаях отмечалась дистальная дислокация стентов. В этих случаях репозиция стентов была достигнута после дополнительных внутрисосудистых манипуляций. Удаление 40 стентов прошло без осложнений. На 2, 3 и 7 сутки после имплантации все сегменты были проходимы. После удаления стента отмечен 1 случай спазма артерии, а в другом случае произошел острый тромбоз артерии сразу после удаления стента. Случаев поздней миграции или поломки стента не отмечалось, дистальной эмболии не было.
При макроскопическом осмотре через 1 сутки после имплантации на эндотелии артерий и аорты отмечены четкие следы от сдавливания ячейками стента, с участками субэндотелиального кровотечения и пристеночного тромбоза (рис. 2)
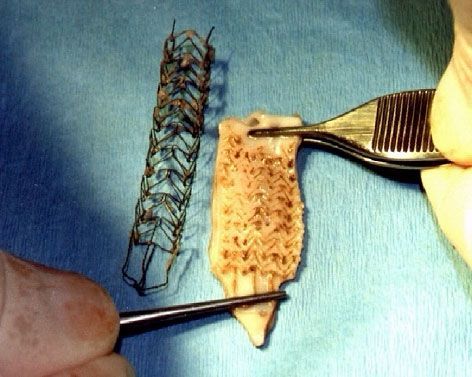
Рис. 2. Сегмент брюшной аорты свиньи после удаления временного стента. Стент (слева) удален на 2-е сутки после имплантации.
На 3 сутки макроскопическая картина была аналогичной (рис. 3)
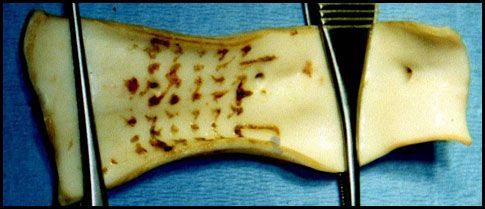
Рис. 3. Сегмент брюшной аорты свиньи после удаления временного стента. Стент удален на 3-е сутки после имплантации.
На 7 сутки несмотря на то, что следы от стента четко визаулизировались, эндотелиальная поверхность макроскопически выглядела наименее травмированной (рис. 4)

Рис. 4. Сегмент брюшной аорты свиньи после удаления временного стента. Стент удален на 7-е сутки после имплантации.
При морфологическом исследовании артериальных сегментов мышечного типа (аорты), во все сроки после удаления стентов, отмечено вдавливание внутренней эластической мембраны артерии элементами стента, с частичной потерей гладкомышечных элементов (Рис.5).
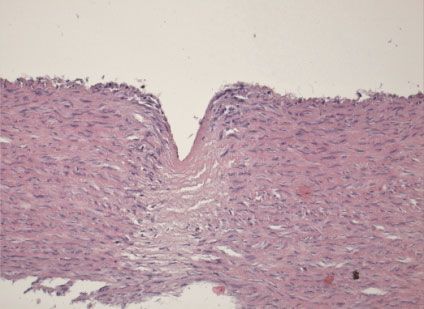
Рис. 5. Микропрепарат сегмента подвздошной артерии экспериментального животного. Вдавленный след от стента на 7 сутки, деструкция элементов гладкомышечного слоя артерии.
В артериях эластического типа (подвздошные артерии) наряду с вышеперечисленными изменениями обнаружены локальные очаги некроза гладкомышечных клеток. В зависимости от срока от момента постановки стента до его удаления изучаемые участки различались по количеству обнаруживаемого тромботического материала. Пристеночный тромбоз был наиболее выражен в артериях, где стент удаляли через 1 сутки. На 7-е сутки после удаления стента пристеночный тромбоз и субинтимальные кровотечения были наименее выражены.
Список литературы
1. Бокерия Л.А., Ступаков И.Н., Самородская И.В. Оценка эффективности методов реваскуляризации миокарда в рандомизированных исследованиях. //Бюллетень НЦССХ Сердечно-сосудистые заболевания. – Общие вопросы сердечно-сосудистой хирургии. – сентябрь-октябрь 2001 г. – Том 2. — №5. – с.16-50.
2. Гланц С. Медико-биологическая статистика. Москва 1999г.
3. Мелихов О.Г., Прудников Д.Н. История и основные положения правил проведения клинических испытаний.//Клиническая фармакология и терапия.1997.-том 6.-номер 1.-с 1-9.
4. Ступаков И.Н., Самородская И.В. Под редакцией академика Бокерия Л.А. ‘Планирование, возможности и ограничения различных типов исследований при оценке эффективности лечения сердечно-сосудистых заболеваний’. НЦССХ им. А.Н. Бакулева 2001г.
5. Auer J., Berent R., Eber B. Neuromodulation als alternative Methode in der Behandlung der therapierefraktaren Angina pectoris.//Wien-Med-Wochenschr. 2001; 151(15-17): 405-8
6. Clarke SC., Schofield,-P-M. Laser revascularization in the management of coronary artery disease. //Hosp-Med. 2001 Jan; 62(1): 8-13
7. Detre K.M, Holubkov R. Coronary revascularization on balance.// Mayo-Clin-Proc. 2002 Jan; 77(1): 72-82.
8. Han R. O., Schwartz R. S., Kobayashi Y. Comparison of self)expanding and balloon)expandable stents for the reduction of restenosis.// Am-J-Cardiol. 2001 Aug 1; 88(3): 253-9
9. Horvath K A Transmyocardial laser revascularization in the treatment of myocardial ischemia. //J-Card-Surg. 2000 Jul-Aug; 15(4):271-7
10. Kwok Y.S., Kim C., Heidenreich P.A. Medical therapy or coronary artery bypass graft surgery for chronic stable angina: an update using decision analysis.// Am)J)Med. 2001 Aug; 111(2): 89-95
11. Maddern G.J. Surgery and evidence)based medicine. //MJA 1998;169:348-349.
12. Morrison D.A., Gulshan S, Sacks J. et al. Percutaneous coronary intervention versus coronary bypass graft surgery for patients with medically refractory myocardial ischemia and risk factors for adverse outcomes with bypass: The VA AWESOME multicenter registry: comparison with the randomized clinical trial.//J)Am-Coll-Cardiol. 2002 Jan 16; 39(2): 266-73
13. McNab DuncanC., Schofield P.M. Transmyocardial and percutaneous myocardial laser revascularization.//Circulation. 2002 May 14; 105(19): e171-2;
14. O’Neill W.W. Michigan R.O. When Should We Start Randomized Trails for New Devices?// Journal of the American College of Cardiology, 1999, № 4
15. Nathan M., Aranki S. Transmyocardial laser revascularization.Curr)Opin)Cardiol. 2001 Sep; 16(5): 310-4
16. Nishida H., Endo M., Koyanagi H. Transmyocardial laser revascularization: overview of clinical and experimental data.//Nippon-Rinsho. 2001 Oct; 59(10): 2071-82
17. Rutanen Juha Markkanen Johanna, Yla Herttuala Seppo. Gene therapy for restenosis: current status.//Drugs. 2002; 62(11): 1575-85
18. Serruys P.W., Unger F., Sousa J.E. et al.Comparison of coronary)artery bypass surgery and stenting for the treatment of multivessel disease. //N-Engl-J-Med. 2001 Apr 12; 344(15): 1117-24
19. Schwenk W., Haase O., Muller J.M. Anderungen der chirurgischen Therapie aufgrund klinischer Studien? //Zentralbl-Chir. 2002 Apr; 127(4): 258-64
20. Transmyocardial laser revascularisation. Canberra: Medicare Services Advisory Committee. Medicare Services Advisory Committee (MSAC). MSAC
21. Jones J.W., Richman B.W. Treatment of refractory angina pectoris by transmyocardial laser revascularization. //Mo-Med. 2001 Apr; 98(4): 148-51.
22. Peterson E.D., Lansky A.J., Anstrom K.J. et al. Evolving trends in interventional device use and outcomes: results from the National Cardiovascular Network Database. Am Heart J 2000;139(2) 320-27.
23. Yusuf S. Effect of coronary artery bypass graft surgery on survival: overview of 10)year results from randomised trials by the Coronary Artery Bypass Graft Surgery Trialists Collaboration. //Lancet; 1994 Nov 19;344(8934):1446.
24. Blumenthal R.S., G.Cohn, S.P.Schulman. Medical therapy versus coronary angioplasty in stable coronary artery disease: a critical review of the literature.// Journal of Am.Coll. Card. 2000.-vol.36.-N3.-p668-73.
6 Шунтирование сосудов сердца
Шунтирование сосудов сердца или коронарное шунтирование — хирургический метод, который применяется в кардиохирургии достаточно долгое время. До внедрения стентирования, данный метод являлся единственным при безуспешности тромболитической терапии. Что собой представляет операция — шунтирование сосудов сердца?
Реваскуляризация миокарда достигается путем создания шунта — сосуда, обеспечивающего обходной кровоток. Это создается с той целью, чтобы заместить функцию пораженной атеросклерозом коронарной артерии. Забор сосуда производится с поверхности бедра, предплечья либо грудной стенки. Это может быть как артерия, так и вена. В последнее время предпочтение отдается артериальному сосуду.
Основные показания к проведению шунтирования:
- Невозможность выполнения коронароангиографии
- Безуспешность коронарного стентирования и тромболитической терапии
- Большое количество пораженных сосудов или их кальциноз
Это лишь основные показания, по которым выполняется коронарное шунтирование.
Возможные осложнения после процедуры
Примерно в 90% случаев после установки стента нормальный ток крови по артериям восстанавливается и никаких проблем не возникает. Но в некоторых случаях возможны такие осложнения:
- Нарушение целостности стенок артерии;
- Кровотечение;
- Проблемы с функционированием почек;
- Образование в месте прокола гематом;
- Рестенозирование или тромбирование в зоне стентирования.
Одним из возможных осложнений является закупоривание артерии. Это бывает крайне редко, и когда это происходит, пациента срочно направляют на аортокоронарное шунтирование. Лишь в 5 случаях из 1000 требуется экстренная операция, но пациенту нужно быть готовым к такой вероятности.
Осложнения при данной операции происходят довольно редко, поэтому стентирование сосудов является одной из самых безопасных хирургических процедур.
Как выполняется стентирование в ЦЭЛТ?
-
Безболезненно
Стентирование проводится без наркоза, т. к. внутри сосудов нет нервных окончаний. -
Безопасно
При стентировании мы используем радиальный доступ — введение катетера через лучевую артерию на запястье. Такой доступ позволяет избежать серьезной кровопотери и намного комфортнее для пациента, чем доступ через бедренную артерию. Пациент может вставать практически сразу после исследования, постельный режим не требуется. -
Эффективно
При сужении или закупорке сосуда мы проводим балонную ангиопластику и стентирование артерий. В пораженный сосуд вводится специальный баллон, которым расширяют место сужения, а следом за ним имплантируется стент.
Область применения стентирования
Стентирование при запущенном атеросклерозе сердца
- Стентирование артерий нижних конечностей – наименее травматичный и в то же время очень эффективный метод лечения заболеваний сосудов ног. При образовании бляшек и нарушении кровотока при ходьбе у пациента появляются боли в области бедер, ягодиц, в стопах и голенях. Развиваясь, заболевание приводит к самым тяжким последствиям, вплоть до гангрены.
- Стентирование сонных артерий – малотравматичное лечение, позволяющее восстановить просвет сосудов. Сонные артерии снабжают кровью головной мозг, и при их стенозе нарушается мозговое кровообращение. Во время операции устанавливаются помимо стента специальные защитные устройства с мембраной – фильтры. Они способны задерживать микротромбы, защищая мелкие сосуды мозга от закупорки, но не препятствуя при этом кровотоку.
- Рестеноз коронарной артерии после ангиопластики. После этой процедуры через 3–6 месяцев у 50% пациентов происходит рестеноз – повторное сужение сосуда в этом же месте. Поэтому для уменьшения вероятности рестеноза ангиопластику обычно дополняет стентирование коронарных сосудов.
- У пациентов с ИБС, перенесших аортокоронарное шунтирование, через десять-пятнадцать лет после операции может произойти стенозирование шунта. В этом случае стентирование становится альтернативой повторной операции коронарного шунтирования.
Какие есть способы введения стентов в организм? И в каких случаях какие делают?
В большинстве случаев проводят с помощью трансфеморального доступа. Это значит, что пациенту не требуется общего наркоза, не производится вскрытие грудной клетки, а стент попадает в организм через общую бедренную артерию.
В ряде случаев стентирование с помощью трансфеморального доступа оказывается по результатам коронарографии невозможным. Чаще всего это происходит в том случае, если у пациента диагностирован синдром Лериша (непроходимость брюшной части аорты и ее крупных ветвей). В таком случае возможно использование трансрадиального доступа, позволяющего ввести стент через лучевую артерию, располагающуюся на предплечье.
Дискуссия.
Сообщений об использовании метода ЧТА при лечении окклюзирующих поражений ПБА огромное количество, при этом авторы приводят очень сильно различающиеся данные, как о клинических и ангиографических показаниях для использования метода, так и об отдаленных результатах вмешательств. Что касается техники операции (способов и механизма реканализации, выбора доступа для вмешательства, выбора инструментов и стентов), она в принципе хорошо отработана. Факторов, воздействующих на отдаленные результаты ЧТА несколько, однако наиболее важными следует считать ангиографические критерии, поскольку именно они определяют проходимость артерии в отдаленном периоде. ([],[],[],[]) Длина поражения, его локализация, состояние «путей оттока» — вот основные критерии, обеспечивающие успех или приводящие к неудовлетворительному результату. До настоящего времени считалось, что лишь при стенотических поражениях ПБА и коротких, менее 5 см, окклюзиях с сохраненным дистальным артериальным руслом может быть успешно применена ЧТА, а в остальных случаях пациенту показана стандартная шунтирующая операция (например, G.Agrifiglio с соавторами, 1999). В подтверждение этого факта, неудовлетворительные результаты описываются как раз при ЧТА бедренно-подколенной зоны при длинных поражениях ([], []). Кроме того, проходимость зависит от зоны поражения: чем дистальнее произведено вмешательство, тем хуже его результаты.
Дискутабельным остается вопрос о стентировании при ЧТА. Резидуальные стенозы после ангиопластики (диссекции, отслойки интимы, эластические стенозы) являются показанием для стентирования в бедренно-подколенной зоне. Однако при исследовании, проведенном Bergeron с соавторами показано, что стенты вызывают неоинтимальную гиперплазию уже через 4 месяца после имплантации []. Другие несколько исследований отдаленных результатов стентирования в этой зоне описывают возникновение рестенозов от 20 до 40% случаев в сроки от 6 до 24 месяцев, вне зависимости от используемой модели стента []. В этих исследованиях авторы пытаются определить причину столь высокой частоты рестенозов, считая одной из них стентирование при окклюзиях. Так при стентировании реканализованного сегмента артерии рестенозы возникают в 33-40%, в то время как стентирование стенозов лишь в 9-18%, второй причиной выделяется зона стентирования в ПБА. В нижней трети бедра рестенозы возникают в 40% случаев, а в верхней трети ПБА лишь в 9%. Количество имплантированных стентов, то есть длина участка артерии, покрытого стентами, тоже влияет на частоту возникновения рестенозов: 1 стент — 3,6% рестенозов в течение 6 месяцев и 18% — в течение 4 лет, а при 2 стентах и более соответственно 7,9% и 34% (25). Стентирование, по мнению большинства исследователей, не улучшает отдаленные результаты в бедренно-подколенной зоне, поскольку увеличивает частоту рестенозов. Предпринятая попытка использования нитиноловых стентов «Smart» (Cordis), покрытых сиролимусом при ангиопластике ПБА, показала лучшие результаты по первичной проходимости по сравнению контрольной группой в сроки 6 мес. Но затем в сроки 12 месяцев результаты практически сравнялись [].
Послеоперационный период и реабилитация
После такого хирургического вмешательства, как стентирование, пациент должен некоторое время соблюдать постельный режим. Лечащий врач контролирует появление возможных осложнений, а при выписке дает рекомендации по диете, приему лекарства, ограничениях и т.д.
В первую неделю после операции следует ограничить физические нагрузки и не поднимать тяжести, нельзя принимать ванну (только душ). В это время нежелательно садиться за руль автомобиля, а если работа пациента связана с перевозкой грузов или пассажиров, то водить не следует, по крайней мере, в течение 6 недель.
Жизнь после стентирования предполагает соблюдение некоторых рекомендаций. После установки стента начинается кардиологическая реабилитация пациента. Ее основой являются диета, ЛФК и позитивный настрой.
Лечебной физкультурой нужно заниматься практически ежедневно минимум по 30 минут. Пациент должен избавиться от лишнего веса, привести в форму мышцы, нормализовать давление. Последнее значительно уменьшает вероятность развития инфаркта миокарда и кровоизлияния
Сокращать физические нагрузки не следует и по окончании реабилитации.
Особое внимание нужно обратить на питание – необходимо соблюдать определенный рацион питания, который поможет не только нормализовать вес, но и повлиять на факторы риска проявления ИБС и атеросклероза. Диета после стентирования сосудов сердца или других сосудов должна быть направлена на снижение показателей «плохого» холестерина – ЛПНП (липопротеиды низкой плотности)
Питание после инфаркта и стентирования должно быть подчинено следующим правилам:Минимизировать жиры – необходимо исключить продукты, содержащие животные жиры: жирные сорта мяса и рыбы, молочные продукты высокой жирности, икра, моллюски
Кроме того, следует отказаться от крепкого кофе, чая, какао, шоколада и пряностей.
Количество продуктов с высоким содержанием полиненасыщенных жирных кислот, наоборот, нужно увеличить.
Включать в меню больше овощей, фруктов, ягод и злаков – они содержат сложные углеводы и клетчатку.
Для приготовления пищи вместо сливочного использовать только растительное масло.
Ограничить прием соли – не более 5 г в день.
Разделить питание на 5–6 приемов, причем последний делать не позднее, чем за три часа до сна.
Суточная калорийность всех употребляемых продуктов не должна превышать 2300 ккал.
Лечение после стентирования имеет очень важное значение, поэтому после операции на протяжении от полугода до года пациенту придется ежедневно принимать лекарства. Стенокардии и других проявлений ишемии и атеросклероза больше нет, но причина атеросклероза осталась, так же, как и факторы риска.
Даже если пациент чувствует себя хорошо, после внедрения стента он должен:
- Принимать назначенные врачом лекарства, предупреждающие риск образования тромбов. Обычно это плавикс и аспирин. Это эффективно предотвращает тромбообразование и закупоривание сосудов, и как следствие, снижает риск инфаркта и увеличивает продолжительность жизни.
- Соблюдать антихолестериновую диету и принимать препараты, снижающие холестерин в крови. Иначе продолжится развитие атеросклероза, а значит, будут появляться новые бляшки, сужающие сосуды.
- При повышенном давлении принимать лекарства для его нормализации – ингибиторы АПФ и бета-блокаторы. Это поможет уменьшить риск развития инфаркта миокарда и инсульта.
- Если пациент страдает сахарным диабетом – соблюдать строгую диету и принимать препараты для нормализации уровня сахара в крови.
Многих пациентов волнует вопрос: могут ли они получить инвалидность после стентирования? Операция улучшает состояние человека и возвращает ему нормальную трудоспособность. Поэтому само по себе стентирование не является показанием к назначению инвалидности. Но при наличии сопутствующих состояний, пациент может быть направлен на МСЭ.
Сравнение стентирования и шунтирования: их плюсы и минусы
Если сравнивать, что лучше – стентирование или шунтирование, для начала нужно определиться, чем они различаются.
Стентирование, в отличие от шунтирования, эндоваскулярный метод и проводится без вскрытия грудной клетки и осуществления крупных разрезов. Шунтирование же чаще всего это полостная операция. С другой стороны, установка шунта является более радикальным методом, позволяющим справиться со стенозом при множественной закупорке или полном перекрытии. Стентирование в таких ситуациях зачастую оказывается бесполезным или невозможным.
Принцип шунтирования сердца
Стентирование чаще всего используется для лечения молодых пациентов с небольшими изменениями сосудов. Пожилым пациентам с серьезными поражениями все-таки показана установка шунта.
При операции стентирования достаточно местной анестезии, а при установке шунта приходится не только использовать общий наркоз, но и подключать больного к аппарату искусственного кровообращения.
Существущая после стентирования риск образования тромбов вынуждает пациентов долгое время принимать специальные препараты. Кроме того, возможен и рестеноз. Новые поколения стентов, конечно, помогают решать эти проблемы, но, тем не менее, это случается. Шунты тоже не идеальны – они, как и любые сосуды, подвержены дегенеративным процессам, атеросклерозу и т.д., поэтому через какое-то время могут выйти из строя.
Сроки восстановления также различаются. После малоинвазивного стентирования больной может покинуть клинику уже на следующий день. Шунтирование предполагает более длительный период восстановления и реабилитации.