Дисметаболическая кардиомиопатия
Содержание:
Прогноз. Профилактика
Естественное течение миокардитов варьирует так же как и его клинические проявления. У ранее здоровых людей почти всегда отмечается восстановление состояния сердечно-сосудистой системы. При миокардитах, связанных с вакцинацией против натуральной оспы, обычно также происходит быстрая нормализация клинических, лабораторных и эхокардиографических показателей.
Если даже заболевание проявляется сердечной недостаточностью, у больных нередко отмечается лишь слабовыраженное нарушение функции желудочков сердца (фракция выброса левого желудочка от 40 до 50 %), а улучшение происходит в течение недель или месяцев.
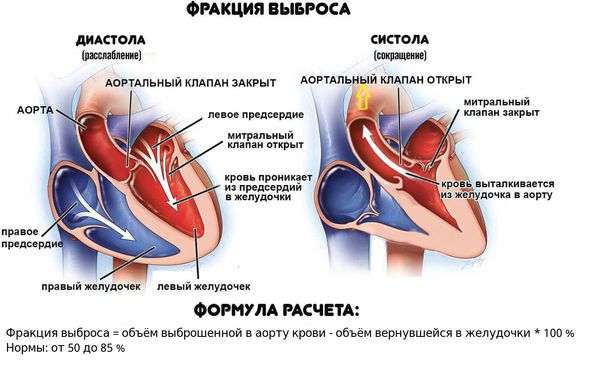
Реже развивается тяжёлое нарушение функции левого желудочка — снижение фракции выброса до 35 % и менее и увеличение конечного диастолического размера левого желудочка до 60 мм и более. В этой группе больных в половине случаев в дальнейшем развивается хроническое нарушение функции левого желудочка, а в 25 % случаев сердечная недостаточность прогрессирует до терминальной стадии, при которой требуется трансплантация сердца или наступает смерть. Однако у оставшихся 25 % больных отмечается спонтанное восстановление функции левого желудочка.
У небольшого числа больных с выраженным нарушением функции левого желудочка заболевание проявляется кардиогенным шоком, при котором нужна механическая поддержка кровообращения. При этом может потребоваться либо достаточно кратковременная поддержка, либо более длительная, продолжающаяся до восстановления функции левого желудочка или трансплантации сердца.
При молниеносном течении миокардита возможен наиболее благоприятный прогноз с выживаемостью, достигающей более 90 %, и без осложнений.
Обморочные состояния, блокада ножек пучка Гиса или снижение фракции выброса левого желудочка менее 40 % можно считать прогностическими показателями смерти или трансплантации сердца. Выраженные симптомы сердечной недостаточности также являются факторами неблагоприятного прогноза.
При вирусных миокардитах в 40-60 % случаев возможно спонтанное восстановление функции миокарда, при этом прогноз благоприятен. Если функции сердечной мышцы не восстанавливаются, то прогноз хуже. В настоящее время отсутствуют надёжные методы, которые позволяли бы прогнозировать спонтанное восстановление функции миокарда. Однако уменьшение числа миоцитов вследствие апоптоза (программируемой гибели клеток) приводит к прогрессированию дисфункции миокарда, так как при этом ограничивается восстановление сердечной мышцы.
Профилактика миокардитов
- проводить санацию очагов хронической инфекции в организме (хронический тонзиллит, гайморит, кариес и др.);
- избегать контакта с людьми, заболевшими вирусными или бактериальными инфекциями;
- вакцинироваться против кори, краснухи, дифтерии, эпидемического паротита, полиомиелита, вируса гриппа;
- соблюдать личную гигиену, что убережёт от поражения грибками, вирусными и бактериальными инфекциями;
- использовать меры защиты от клещей (репелленты, защитная одежда) и других насекомых для исключения заражения болезнями, возбудителей которых переносят эти насекомые;
- вести здоровый образ жизни для профилактики острых респираторных вирусных и бактериальных инфекций.
Важно помнить, что лечение при миокардите назначает врач-кардиолог, самолечение опасно и недопустимо.
Лечение миокардов
Во всех случаях установленного диагноза миокардит пациент должен получать терапию, рекомендованную при ХСН (хронической сердечной недостаточности), которая включает применение следующих групп препаратов:
- бета-адреноблокаторы (карведилол, метопролол и др.);
- ингибиторы АПФ или сартаны ( например эналаприл, кандесартан);
- ингибиторы минералокортикоидных рецепторов (верошпирон).
Обсуждается применение статинов в комплексном лечении миокардитов, как препаратов обладающих, в том числе и противовоспалительным эффектом.
Другие группы препаратов применяются по показаниям, в зависимости от клинического состояния пациента. Это могут быть сердечные гликозиды (дигоксин), антиаритмические препараты (только амиодарон, редко соталол), а при тяжелом течении может применяться иммуносупрессивная терапия (преднизолон или цитостатики).
Рутинное применение иммуноглобулина не рекомендуется.
Диагностика
Установить точный диагноз больного, врач может только после проведения полного обследования. Вначале пациент рассказывает специалисту о наличии приобретенных заболеваний, возможных наследственных. Затем больного осматривают и прослушивают у него сердечные ритмы, дабы зафиксировать перебои, которые могут указывать на возникновение патологии
Пациент также проходит исследования электрокардиографии, ультразвуковые, рентгенографии, благодаря которым можно зафиксировать нарушения в работе важного органа, его структурные изменения и обнаружить дисметаболическую кардиомиопатию. С помощью клинических анализов крови и мочи распознается степень развития некроза в мышечной ткани сердца, анализируется функция почек
Иногда во время процесса диагностики возникают некоторые затруднения из-за отсутствия видимых признаков болезни. В таком случае больному потребуется сделать магнитно-резонансную томографию и записаться на консультацию к эндокринологу, аритмологу и генетику.
Лечение
Чем раньше будет начато лечение энцефалопатии, тем больше шансов остановить прогрессирование патологии и восстановить полноценную работу головного мозга.
В первую очередь, необходимо устранить причину поражения нейронов:
- скорректировать уровень сахара в крови;
- стабилизировать артериальное давление;
- восстановить работу печени, почек, поджелудочной железы;
- снизить уровень холестерина в крови;
- вывести токсины;
- нормализовать уровень гормонов и т.п.
Лечение непосредственно энцефалопатии требует назначения препаратов, улучшающих кровоток в сосудах головного мозга и обмен веществ внутри клетки. В зависимости от причины и степени поражения, врачи могут назначить:
- ноотропы (церебролизин, пирацетам): направлены на усиление метаболизма;
- кроворазжижающие средства (аспирин, пентоксифиллин и т.п.): способствуют ускорению кровотока, препятствуют образованию тромбов;
- антиоксиданты: нейтрализуют токсины;
- ангиопротекторы (кавинтон, никотиновая кислота и другие): необходимы для ускорения кровообращения и обмена веществ;
- витаминно-минеральные комплексы, аминокислоты;
- симптоматические средства: успокоительные, противосудорожные препараты и т.п.
При энцефалопатии курсы лечения проводятся регулярно, минимум 2 раза в год. Это позволяет держать заболевание под контролем. Подбор конкретных препаратов и определение дозировки осуществляется только врачом. Единой схемы лечения для всех больных не существует.
Для усиления действия лекарственных препаратов используются немедикаментозные методы лечения:
- физиотерапия (рефлексотерапия, электрофорез, магнитотерапия, лазерная терапия);
- лечебная физкультура для улучшения состояния мышц, облегчения контроля за ними;
- массаж для расслабления и улучшения кровообращения;
- иглоукалывание.
В отдельных случаях (при сосудистой природе энцефалопатии) приходится прибегать к хирургическому лечению:
- устранение тромба из просвета сосудов;
- расширение суженных участков артерии с установкой стента, поддерживающего стенки в правильном положении;
- шунтирование: восстановление кровотока за счет создания альтернативного пути, обходящего пораженный участок.
Диагностика
Кроме анамнеза с указанием на болезни сердца и другие патологии, врачу важен осмотр и типичные жалобы пациентов. Но основными методами диагностики кардиосклероза являются:
- УЗИ сердца с оценкой его сократимости, строения, размеров и формы,
- доплерография сосудов с оценкой кровотока по коронарным сосудам, участков ишемии миокарда, состояние клапанов сердца и т.д.,
- ЭКГ с изменениями в проводящей системе, наличие инфарктов свежего происхождения или в рубцовой стадии с их точной локализацией.
- рентген сердца с нескольких проекциях, для визуальной оценки его размера и состояния.
- КТ и МРТ сердца с обнаружением участков измененного миокарда.
Эндомиокардиальный фиброз
Это эндемичное для экваториальных стран заболевание (Уганда, Нигерия, Бразилия) и редко развивается в нетропических странах. Заболевание возникает обычно в молодом возрасте одинаково часто у мужчин и женщин и приводит к смерти в течение 1 года–4 лет с момента появления первых симптомов.
Эндомиокардиальный фиброз характеризуется значимым утолщением и рубцеванием эндокарда, приводящим к облитерации полости желудочка. Пристеночный тромбоз и системные эмболы могут вызвать еще большее уменьшение объемов полостей желудочков. Часто в процесс вовлекается и субэндокардиальный миокард. Эндомиокардиальный фиброз вовлекает оба желудочка в 50% случаев, ЛЖ — в 40%, ПЖ — в 10%, его отмечают в трех различных областях: верхушке ЛЖ или ПЖ и субклапанном пространстве. Обычно ПЖ становится более облитерированным, чем ЛЖ.
Микроскопически в эндокарде выявляют толстый коллагеновый слой поверх соединительной ткани с грануляциями, достигающими миокарда. Митральный и трехстворчатый клапаны могут фиброзироваться, вследствие чего возникает клапанная регургитация.
Клиника эндомиокардиального фиброза зависит от того, какой желудочек вовлечен в патологический процесс. При левостороннем поражении превалирует застой в легких, при правостороннем — симптомы правожелудочковой СН. Часто возникает митральная и трикуспидальная регургитация, у 25% — фибрилляция предсердий, особенно при поражении ПЖ. У больных также часто выявляют эмболии, выпот в плевральную и перикардиальную полость.
При эхоКГ-исследовании определяется облитерация верхушек желудочков и гиперкинез базальных отделов, дилатация предсердий, при левостороннем поражении — снижение подвижности задней створки митрального клапана, при допплеровской эхоКГ — признаки митральной и трикуспидальной регургитации, рестриктивный тип наполнения желудочков.
Катетеризация сердца подтверждает рестриктивный тип гемодинамики.
При эндомиокардиальной биопсии выявляют эозинофильные инфильтраты, что подтверждает диагноз.
Общий прогноз неблагоприятный, показано паллиативное лечение — хирургическая резекция фиброзного эндокарда и замена клапана, которое может улучшить симптомы, хотя интраоперационная смертность составляет 15–25%. У больных с тяжелым течением 2-летняя смертность составляет 35–50%.
Клиническая картина
Клинические симптомы тесно связаны с величиной давления в левом предсердии, необходимом для компенсации недостаточного наполнения желудочка. Это приводит к типичному нарушению толерантности к физической нагрузке в ранних стадиях и одышке в покое и симптомам низкого сердечного выброса (повышенная слабость) при дальнейшем развитии. Повышение ЧСС уменьшает время диастолы и уменьшает адекватное наполнение желудочков. Клинические симптомы зависят от типа поражения сердца: правожелудочкового, левожелудочкового или смешанного право- и левожелудочкового. Кардиалгический синдром и синкопальные состояния нехарактерны.
К наиболее характерным клиническим симптомам рестриктивной кардиомиопатии относят:
1. При поражении ПЖ:
- увеличение сердца с преобладанием гипертрофии и дилатации правых отделов, тяжелая правожелудочковая недостаточность;
- трехчленный ритм (ритм галопа), систолический шум недостаточности трехстворчатого клапана;
- повышение венозного давления, набухание яремных вен;
- увеличение печени;
- выраженные периферические отеки, асцит, анасарка.
2. При поражении ЛЖ:
- систолический шум;
- признаки левожелудочковой недостаточности;
- митральная недостаточность;
- увеличение размеров левого предсердия;
- застой в легких;
- гипертензия малого круга кровообращения.
3. При поражении обоих желудочков:
тотальная СН.
4. Выпот в перикард, плевру.
5. Тяжелые нарушения ритма (фибрилляция предсердий, эктопические аритмии).
6. Тромбоэмболический синдром.
Диагностика
На ЭКГ определяются:
- спонтанные желудочковые тахикардии с изменением комплекса QRS по типу блокады левой ножки пучка Гиса;
- отрицательные зубцы Т в отведениях V1–4 на фоне синусового ритма;
- уширение комплекса QRS;
- неполная блокада правой ножки пучка Гиса;
- эктопические тяжелые аритмии: желудочковая экстрасистолия, фибрилляция желудочков, предсердная тахикардия, фибрилляция предсердий.
Приблизительно у ⅓ пациентов регистрируется характерная эпсилон-волна и ППЖ.
Методом холтеровского мониторирования можно диагностировать эпизоды желудочковой тахиаритмии
Для оценки прогрессирования заболевания важно проводить регистрацию ЭКГ в динамике
При эхоКГ-исследовании выявляются:
- дилатация ПЖ и нарушение его сократимости (асинергия, диффузная гипокинезия, снижение ФВ);
- локальная аневризма ПЖ;
- повышенная трабекулярность;
- трикуспидальная регургитация;
- эмболия ЛА;
- увеличение правого предсердия;
- левые отделы сердца чаще не изменены.
С помощью допплер-эхоКГ определяется нарушение диастолической функции ПЖ и трикуспидальная регургитация. Для более точной визуализации ПЖ применяют контрастную эхоКГ миокарда.
Методом МРТ визуализируются участки замещения миокарда жировой тканью, фокальное истончение стенки и локальные аневризмы. Продемонстрирована хорошая корреляция между результатами этого метода и результатами морфологического исследования миокарда.
Для подтверждения диагноза используют рентгенконтрастную вентрикулографию, при которой выявляют дилатацию ПЖ с сегментарными нарушениями его сокращения, выпячивания контура в области дисплазии и повышение трабекулярности.
При эндомиокардиальной биопсии определяют фиброзно-жировую инфильтрацию миокарда ПЖ.
Из-за трудностей и риска проведения биопсии для подтверждения диагноза «аритмогенная кардиомиопатия ПЖ», а также неточностей в оценке структуры и функции ПЖ с помощью неинвазивных тестов Европейским кардиологическим обществом и Международным обществом и кардиологической федерацией разработаны критерии, согласно которым диагноз устанавливают при наличии 2 больших или 1 большого + 2 малых или 4 малых диагностических критериев (Corrado D. et al., 2000).
Большие диагностические критерии:
- семейный характер заболевания, подтвержденный данными аутопсии или при хирургическом вмешательстве;
- эпсилон-волна или локализованное уширение комплекса QRS (>110 мс) в правых грудных отведениях (V1–V3);
- фибролипоматозное замещение миокарда по данным эндомиокардиальной биопсии;
- значительная дилатация и снижение ФВ ПЖ при отсутствии или минимальном вовлечении ЛЖ;
- локализованная аневризма ПЖ;
- выраженная сегментарная дилатация ПЖ.
Малые диагностические критерии:
- наличие в семейном анамнезе случаев преждевременной внезапной смерти (у лиц в возрасте моложе 35 лет) вследствие предполагаемой аритмогенной кардиомиопатии ПЖ;
- ППЖ на усредненной ЭКГ;
- инвертированный зубец Т в правых грудных отведениях у лиц в возрасте старше 12 лет при отсутствии блокады правой ножки пучка Гиса;
- желудочковая тахикардия с признаками блокады левой ножки пучка Гиса, документированная по ЭКГ или результатам холтеровского мониторирования или во время нагрузочного теста;
- частые желудочковые экстрасистолы (>1000/24 ч при холтеровском мониторировании ЭКГ);
- умеренная глобальная дилатация или снижение ФВ ПЖ при неизмененном ЛЖ;
- умеренная сегментарная дилатация ПЖ;
- регионарная гипокинезия ПЖ.
Причины миокардита и механизмы формирования кардиосклероза после него
Миокардит, как и любой воспалительный процесс, может возникать вследствие внедрения в нормальную ткань вирусов, бактерий, грибков и простейших микроорганизмов (токсоплазмы). Любой инфекционный агент приводит к выделению медиаторов воспаления, другими словами, формируется септическое расплавление нормальной ткани. В связи с тем, что кардиомиоциты не могут регенерировать и восстанавливаться до нормальных размеров, постепенно они замещаются соединительной тканью – сначала нежной и мелковолокнистой, а затем грубой рубцовой.
В связи с этим мышечный каркас сердца постепенно теряет свою упругость и эластичность, что обуславливает потерю сократительной способности сердца. Плюс к этому под воздействием довольно высокого кровяного давления, с которым кровь проталкивается из левого желудочка в аорту, постепенно формируется расширение камер сердца, потому что такое давление способна выдержать только мышечная ткань, но не рубцовая. В итоге у пациента развивается хроническая сердечная недостаточность, как правило, вследствие дилатационной кардиомиопатии из-за диффузного кардиосклероза.
Процесс развития ХСН может длиться годами и десятилетиями, а может протекать быстро, за несколько месяцев, с развитием тяжелейшей декомпенсации ХСН и быстрым ее прогрессированием до терминальных стадий.
Кроме инфекционных агентов, к развитию воспаления может привести внедрение в миокард иммунных комплексов и ауто-антител, образование которых обусловлено ревматизмом, ревматоидным артритом, системной красной волчанкой, склеродермией и некоторыми другими ревматологическими заболеваниями. При этом у пациента наряду с поражением других внутренних органов развивается миокардит аутоиммунной природы, также способный приводить к развитию соединительной ткани в миокарде.
Другими причинами, способными спровоцировать возникновение острого неинфекционного миокардита, может стать воздействие химиотерапевтических препаратов, используемых для лечения злокачественных опухолей, а также лучевого излучения, используемого при лучевой терапии опухолевых процессов.
пример изменений в сердечной мышце при кардиосклерозе
В зависимости от того, какой объем поражения возникает в сердечной мышце, выделяют очаговый и диффузный кардиосклероз. В первом случае у пациента могут отмечаться как единичные, так и множественные очаги склероза в миокарде, во втором формируется циркулярное равномерное замещение рубцовой тканью. Очаговый кардиосклероз, представленный единичным очагом, несомненно, является более прогностически благоприятным, в том случае, если не вызывает значимых нарушений сердечного ритма, которые сами по себе уже могут привести к изнашиванию сердечной мышцы с развитием острой или хронической сердечной недостаточности.
Список литературы
1. Afzal N., Ganguly Р. K., Dhallo К. S. // Diabetes. — 1988. — Vol. 37. — P. 936-942.
2. Ashavaid Т. F., Colvin R. A., Messineo F. С. // J. mol. cell. Cardiol. — 1985. — Vol. 17. — P. 851-861.
3. Berge С. H., Hjalmarson A., Sjogren K. G., Jacobsson B. // Horm. Metab. Res. — 1988. — Vol. 20. — P. 381—386.
4. Bing R. J., Siegel A., Ungar L., Gulbert M. // Amer. J. Med. — 1954. — Vol. 16. — P. 504-515.
5. Brutsaert D. L., Sys S. U., Gillebert T. C. // J. Amer. Coll. Cardiol. — 1993. — Vol. 22. — P. 318-325.
6. De Fronzo R. A. // Diabetes. — 1988. — Vol. 37. — P. 666- 687.
7. Dhalla N. S., Kolar E, Shah K. R., Ferrari R. // Cardiovasc. Drugs Ther. — 1991. — Vol. 5. — P. 25-30.
8. Dimitar Ch. R. // Clin. Cardiol. — 1993. — Vol. 16. — P. 784-790.
9. Farese R. V., Cooper D. R. // Diabet. Metab. Rev. — 1989. — Vol. 5. — P. 455-474.
10. Fields L. E., Daugherty A., Bergmann S. R. // Amer. J. Physiol. — 1986. — Vol. 250. — P. 1079-1085.
11. Greene D. A., Lattimer J. A., Sima A. F. // N. Engl. J. Med. — 1987. — Vol. 316. — P. 599-606.
12. Kannel W. B., Hjortland M., Castelli W. P. // Amer. J. Cardiol. — 1974. — Vol. 34. — P. 29-34.
13. Kobayashi K, Neely J. R. // J. mol. cell. Cardiol. — 1983. — Vol. 15. — P. 347-357.
14. Litvin S. E., Grossman W. // J. Amer. Coll. Cardiol. — 1993. — Vol. 22, Suppl. A. — P. 49A-55A.
15. Nicholl T. A., Lopaschuk G. D., McNeill J. H. // Amer. J. Physiol. — 1991. — Vol. 261. — P. 1053-1059.
16. Nitenberg A., Valensi P. // Diabetes. — 1993. — Vol. 42. — P. 1017-1025.
17. Orrenius S., McConkey D. J., Bellomo G. // Trends Pharmcol. Sci. — 1989. — Vol. 10. — P. 281-285.
18. Patino R., Ibarra J., Molino A. // Diabetologia. — 1994. — Vol. 37, N 3. — P. 333.
19. Pieper G. M., Murray M. J. // Biochem. Med. Metab. Biol. — 1987. — Vol. 38. — P. 111-120.
20. Popper D. A., Shiau Y. F., Reed M. // Amer. J. Physiol. — 1985. — Vol. 249. — P. 161-167.
21. Randle P. J., Hales C. N., Garland P. B. // Lancet. — 1963. — Vol. 1. — P. 785-789.
22. Randle P. J., Kerbey A. L., Espinal J. // Diabet. Metab. Rev. — 1988. — Vol. 4. — P. 623-638.
23. Reaven G. A., Chag H., Hoffmal В. B. // Diabetes. — 1988. — Vol. 37. — P. 28-32.
24. Regan T. J., Lyons M. M., Ahmed J. J. et al. // J. clin. Invest. _ 1977. _ vol. 60. — P. 885-899.
25. Rodrigues B., McNeill J. H. // Cardiovasc. Res. — 1992. — Vol. 26. — P. 913-922.
26. Rosen P., Ballhausen T. // Diabetologia. — 1995. — Vol. 38. — P. 1157-1168.
27. Rubier S., Diugash J., Yuceoglu Y. Z. et al. // Amer. J. Cardiol. — 1972. — Vol. 30. — P. 595-602.
28. SchafferS. W. // Mol. cell. Biochem. — 1991. — Vol. 107. — P. 1-20.
29. Shipp J. C., Opie L. H., Chailoner D. // Nature. — 1961. — Vol. 189. — P. 1018-1019.
30. Solomon S. S., Heckemeyer С. M., Barker J. A. // Endocrinology. — 1985. — Vol. 117. — P. 1350-1354.
31. Stevens M. J. // Diabet. Med. — 1995. — Vol. 12. — P. 292— 295.
32. Trovati M., Massucco P., Mattiello L. // Diabetologia. — 1995. -Vol. 38. — P. 936-941.
33. Weber К. T., Anversa P., Armstrong P. W. et al. // J. amer. Coll. Cardiol. — 1992. — Vol. 20. — P. 3-16.
Первые признаки и симптомы миокардиопатии – как вовремя заметить?
Симптоматическая картина рассматриваемой патологии будет определяться ее разновидностью, а также степенью поражения сердечной мышцы.
- Бледность кожных покровов.
- Отечность нижних конечностей. На запущенных стадиях жидкость скапливается в легких и брюшине.
- Синюшность лица в районе ногтевой пластины пальцев.
- Сложности с дыханием даже при минимальной физической нагрузке.
- Боли в груди, которые можно устранить посредством приема нитроглицерина.
- Увеличения диаметра вен на шее.
- Повышение артериального давления. Подобным образом организм пытается компенсировать дефицит оксигена в крови.
Аналогичные жалобы присутствуют при алкогольной кардиомиопатии. Боли в груди, однако, снять при помощи нитроглицерина не удается. Симптоматика приобретает выраженные черты по мере увеличения количества алкогольных эксцессов. Жалобы не прекращаются в течение нескольких дней — либо недели — после последнего приема алкоголя.
Рестриктивная кардиомиопатия характеризуется аналогичной симптоматикой, что и у предыдущей формы заболевания. Однако по мере прогрессирования дегенеративных явлений печень увеличивается в размерах – ее можно прощупать. Сбои в сердцебиении становятся частыми и выраженными, что нередко заканчивается обмороком.
При гипертрофической кардиомиопатии жалобы у пациентов могут отсутствовать годами. К врачу обращаются, зачастую, на последних стадиях болезни, когда развивается сердечная недостаточность. Общая картина может дополняться головокружениями и обмороками.
Аритмогенная форма заболевания сопровождается сбоями в сердцебиении, что имеют приступообразную природу. Подобные патологические состояния зачастую дают о себе знать в периоды интенсивных физических нагрузок. Рассматриваемый вид кардиомиопатии считается одним из самых опасных.